肝癌免疫微环境:肝细胞癌的治疗意义
肝脏是人类原发性癌症的第六大常见部位,也是全球癌症相关死亡的第四大原因。肝细胞癌(HCC)占肝癌的90%。肝癌是一种流行疾病,其进展受免疫系统的调节。一半的HCC患者接受全身治疗,传统的是索拉非尼或仑伐替尼作为一线治疗。在过去的几年里,免疫检查点抑制剂(ICIs)已经彻底改变了癌症治疗,并在HCC的治疗中获得了越来越多的关注。2020年,与索拉非尼相比,阿替利珠单抗(抗程序性死亡配体1)和贝伐珠单抗(抗血管内皮生长因子)的联合治疗提高了总生存率,获得美国食品和药物管理局(FDA)批准作为晚期HCC患者的一线治疗方法。尽管取得了这些重大进展,但仍需要对肿瘤微环境进行更好的分子和细胞表征,因为它在HCC的发生发展中起着至关重要的作用。炎症(热)和非炎症(冷)HCC肿瘤和基因组特征与对ICIs的反应相关。然而,没有额外的生物标记物来指导临床决策。其他免疫靶向策略,如过继T细胞转移、疫苗接种和病毒治疗,目前正在开发中。本文综述了肝癌的免疫微环境、不同的细胞因子、目前可用的免疫疗法和潜在的免疫治疗模式。
肝脏免疫微环境
肝脏含有大量的免疫细胞:中性粒细胞、单核细胞、常驻巨噬细胞(KCs)、自然杀伤细胞(NK)、自然杀伤T细胞(NKT)和肝中转和/或常驻淋巴细胞(B、CD8+ T、cd4 + T和γδ T细胞)。肝脏环境对肠道衍生的微生物代谢物具有高度的耐受性,以维持整体的内稳态。这种免疫耐受源于肝细胞(肝细胞、内皮细胞、KCs和树突状细胞[DCs])和周围白细胞之间的连续抗原呈递,而没有共刺激分子,使KC衍生的IL- 10诱导调节性T细胞(Treg)扩增。抗炎细胞因子(IL- 10、IL- 13和转化生长因子β [TGF- β])和促炎细胞因子(IL- 2、IL- 7、IL- 12、IL- 15和干扰素γ [IFN- γ])之间保持整体平衡,维持稳态。慢性肝病导致炎症信号上调,并引起与坏死炎症相关的体内平衡失衡。在慢性HBV感染期间,循环HBV或HBV衍生抗原的负荷促进T细胞失活(衰竭)和随后的死亡,与全身免疫减弱有关。
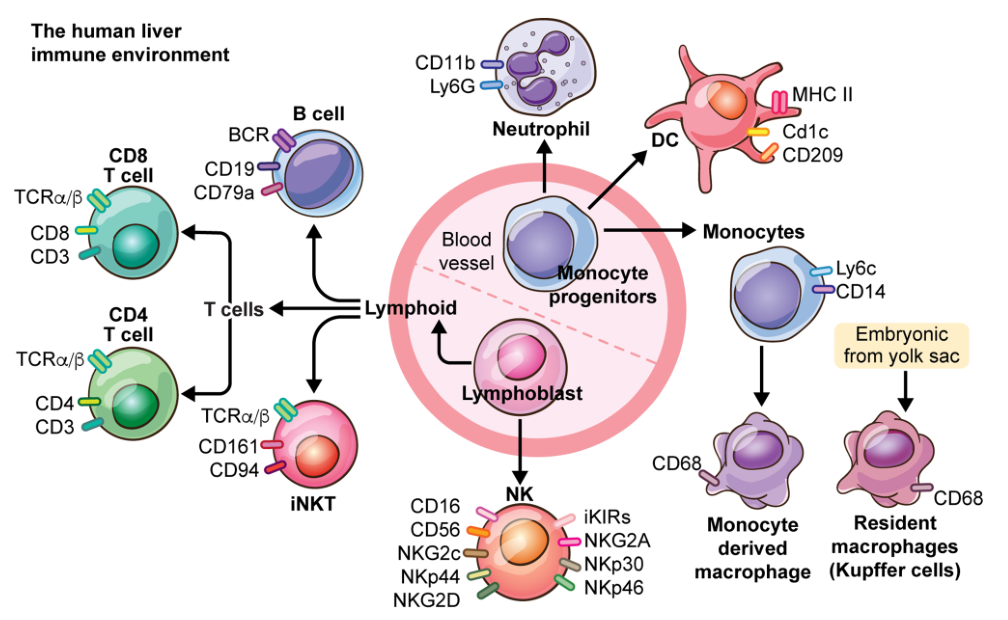
大多数HCC在这种慢性免疫抑制性坏死性炎症环境中发生。与免疫检查点分子增加相关的T细胞共刺激因子的减少导致T细胞效应功能受损。在癌症中,特别是在肝癌中,TME促进癌细胞的生长,并为它们形成一个安全的生态位,以平衡免疫系统的激活。此外,HCC肿瘤呈现中间突变负荷和许多不同的免疫逃避机制。最近基于单细胞RNA测序(scRNAseq)的研究表明,HCC细胞在患者间表现出高度的差异性,而TME表现出反复出现的基因表达特征,在患者间更为一致。这些结果表明,针对TME的策略,如免疫疗法,可能对HCC患者更有效。
- 中性粒细胞:朋友还是敌人?
中性粒细胞是先天免疫细胞,是感染、损伤或肿瘤发生时最先渗透组织的细胞之一。在一些人体实体肿瘤中,肿瘤相关中性粒细胞(TANs)的高浸润水平已被证明与肿瘤生长、淋巴结转移和不良预后相关。然而,TANs有两种:抗肿瘤(N1)或原肿瘤(N2)。
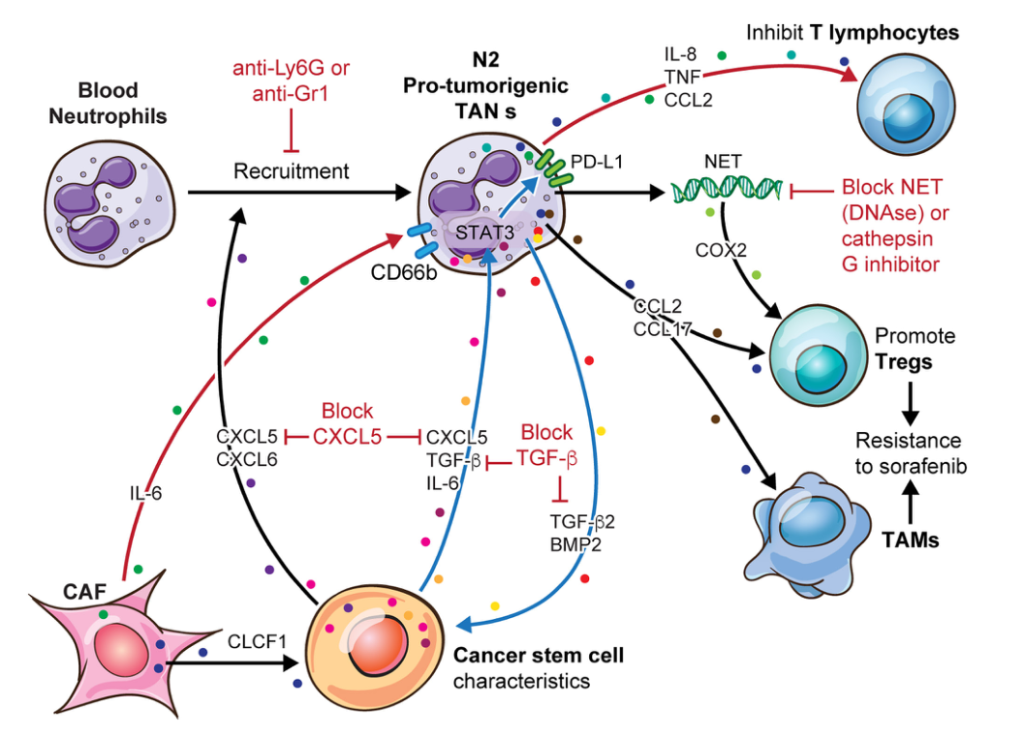
在肝细胞癌(HCC)中抑制TANs免疫抑制功能的策略可能包括使用免疫疗法(抗Ly6G或抗Gr1)阻止它们的募集,用DNase或组织蛋白酶G抑制剂阻断原致瘤性NETosis机制,或阻断一些细胞因子通路,如CXC5或TGF- β。
- 单核细胞:杰基尔医生还是海德先生?
单核细胞是先天免疫细胞,在癌症中起着二分作用。它们通常通过肿瘤CCL2的产生被招募到肿瘤中。在HCC中,单核细胞的不同亚群在致瘤过程中已被表征。在早期阶段,募集的单核细胞能够杀死肿瘤细胞;然而,逃避免疫监视的肿瘤通过将单核细胞重编程为免疫抑制细胞来阻碍单核细胞诱导的死亡。
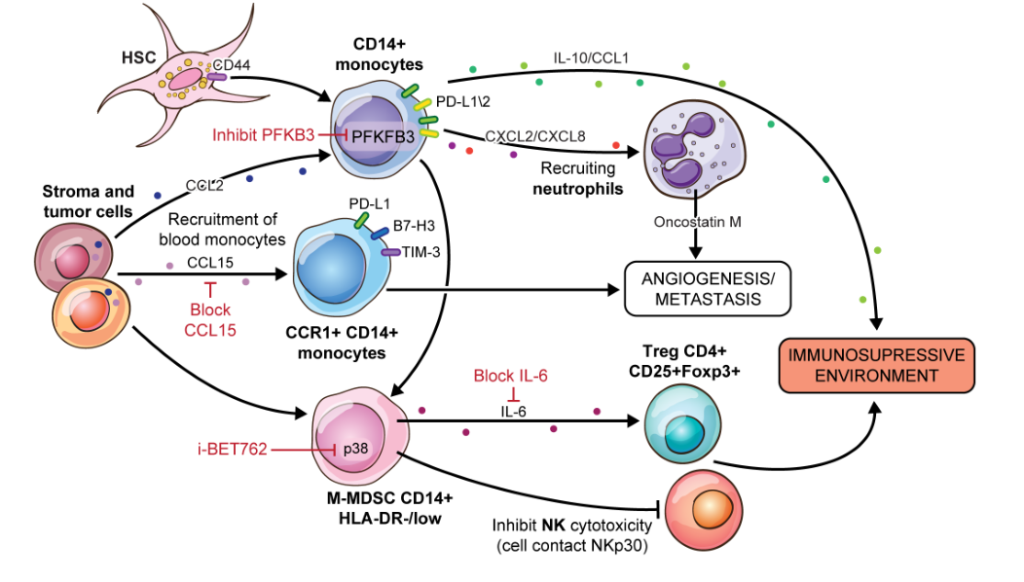
通过单核细胞控制肿瘤发生的方法可能是通过抑制CCL15途径阻止它们向肿瘤的募集,通过抑制p38途径阻止它们的极化,或通过抑制IL- 6途径防止Treg的形成。
- 巨噬细胞:坚韧的细胞
在内稳态中,单核细胞来源的细胞发育为肝脏树突状细胞或巨噬细胞。此外,肝脏中含有大量的巨噬细胞,即KCs,这些巨噬细胞在胚胎发生过程中来源于卵黄囊衍生的前体。KCs被危险信号激活,然后通过诱导免疫细胞(包括单核细胞)的募集促进慢性肝脏炎症。巨噬细胞根据其所受的环境刺激可分为M1和M2两种主要亚型。M1巨噬细胞由微生物成分或促炎细胞因子(TNF, I FN – γ, toll样受体[TLR])诱导,并通过释放一氧化氮、活性氧和促炎细胞因子IL- 1、IL- 6、IL- 12、TNF- α、CXCL5和CXCL8/10发挥促炎功能。M2巨噬细胞被IL- 4、IL- 10、IL- 13和糖皮质激素极化,发挥免疫抑制作用,促进组织修复。
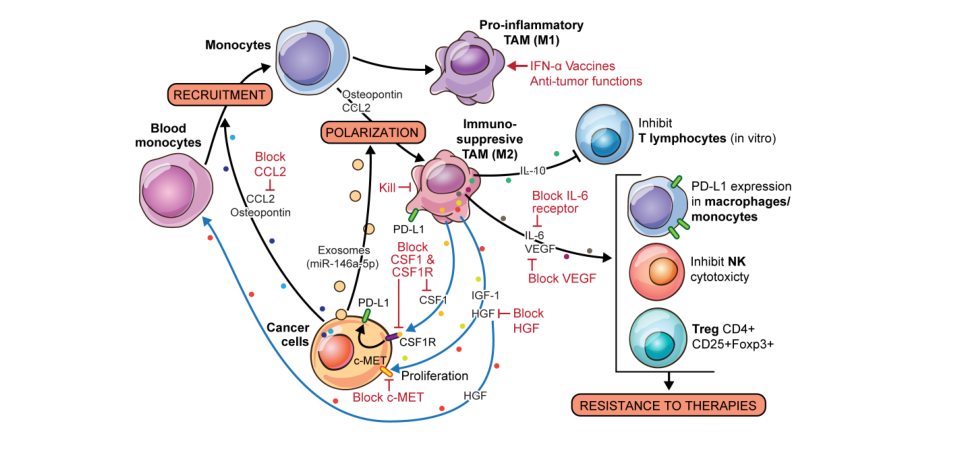
阻断它们的招募(抗CCL2)或阻止它们的原致肿瘤功能(抑制VEGF、HGF、c- MET或IL- 6途径、干扰素α [IFN- α]疫苗)可导致肿瘤负担减轻。
- 树突状细胞使T细胞转动
树突状细胞是先天免疫和适应性免疫之间的重要联系,因为它们协调抗原呈递,导致T细胞的激活和分化。与巨噬细胞相比,树突状细胞具有迁移特性,并向组织引流淋巴结中的T细胞呈递抗原;然而,许多DC – T细胞的相互作用也发生在肝脏中。CD8+ T细胞的激活依赖于CD4+ T辅助细胞(Th)对DC的先前激活。一个功能完整的免疫突触由三个调节步骤定义。首先,DC必须将抗原在MHC II类分子上呈送给CD4+ Th细胞,在MHC I类分子上呈送给CD8+ T细胞。其次,免疫球蛋白超家族(CD80- CD86/CD28)和TNF超家族(CD40L/CD40, 4- 1BBL/4- 1BB, CD27/CD70, CD30L/ CD30,和HVEM/LIGHT)的共刺激分子的相互作用必须发生,以触发细胞因子(第三步)的产生,刺激CD8+ T细胞的膨胀和分化,如IL- 12和I型IFN。CD4+ Th细胞(“经典授权”)或NKT细胞(“替代授权”)可促进CD8+ T细胞授权。这三个步骤之一的干扰将导致功能失调的适应反应。因此,癌细胞逃避免疫监视的主要机制之一就是破坏这个免疫突触,通常通过抑制配体的表达来阻止T细胞的激活。
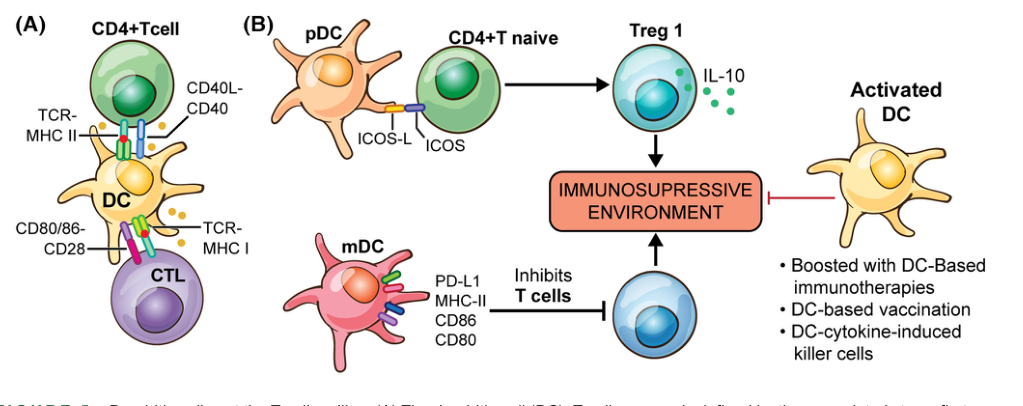
(B)浆细胞样DC (pDCs)可以通过ICOS- L/ICOS相互作用从幼稚的CD4+ T细胞诱导1型调节性T细胞(Tr1),允许调节性T细胞(treg)产生IL- 10。LAMP3+ DCs (mDCs)也可以表达抑制性配体,如程序性死亡配体1 (PD- L1)、Gal9 (TIM3的配体)、MHC- II(用于淋巴细胞激活3 [LAG3])、CD86和CD80(用于细胞毒性T淋巴细胞相关蛋白4 [CTLA4])。这些机制导致免疫抑制环境。
人工激活树突状细胞(免疫疗法,疫苗接种…)可以导致有利于抗肿瘤反应的免疫活性环境。
- Nk细胞进行杀伤
NK细胞是一种颗粒状CD3−淋巴细胞群,可触发针对病原体和恶性细胞的直接先天免疫反应。它们约占人类外周血淋巴细胞的10%,并被细分为两个主要群体:免疫调节剂(CD56bright/CD16−)亚群和细胞毒性(CD56dim/CD16+)亚群。NK细胞表达抑制性受体,如抑制性杀手免疫球蛋白样受体和C型凝集素样受体NKG2A,分别结合MHC- I和非经典的MHC- I复合体HLA- E。细胞上缺乏这些配体会激活NK受体(NKp30、NKp46、NKp44、NKG2D和NKG2C),这些受体会与在感染或肿瘤转化细胞上表达的假定配体结合。外周血NK细胞的高细胞毒活性与降低癌症风险正相关。树突状细胞通过直接接触和大量的炎症细胞因子(IL- 15, IL- 12, IL- 18)促进NK细胞增殖,刺激细胞因子的产生,诱导细胞溶解活性,在NK细胞介导的抗肿瘤活性中也发挥着重要作用。
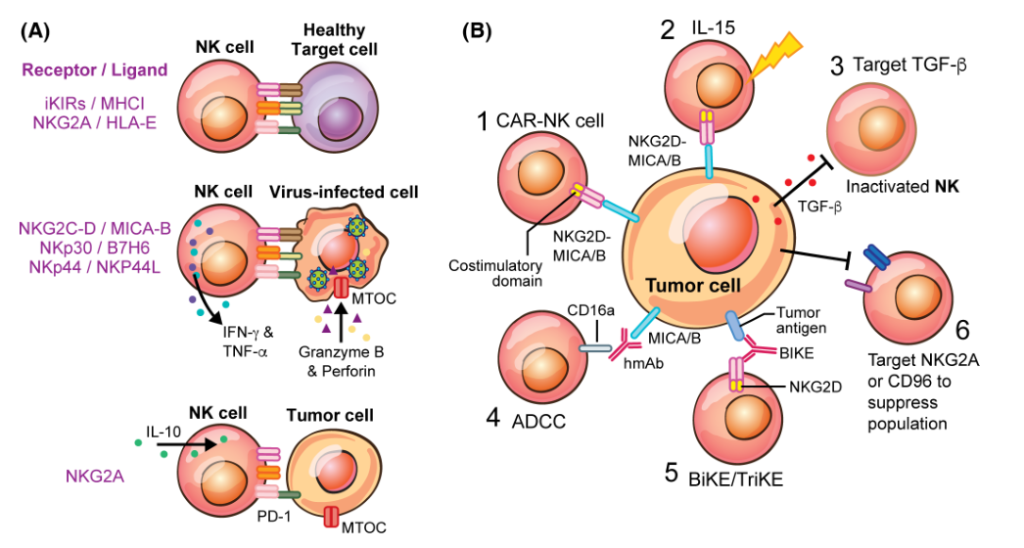
(B)肿瘤抑制NK细胞,但在肿瘤发生过程中发现了六种不同的重新激活NK细胞的方法:使用修饰的NK细胞(嵌合抗原受体[CAR]- NK), IL- 15刺激,靶向转化生长因子β (TGF- β),使用结合肿瘤细胞和NK细胞的抗体(抗体依赖性细胞细胞毒性[ADCC]和双特异性杀伤接合物[BiKE]/三特异性杀伤接合物[TriKE]),以及抑制NKG2A或CD96来抑制免疫抑制NK细胞。
- T细胞是抗肿瘤的领头羊
在肝癌中,CD8+和CD4+ T细胞分别在肿瘤内部和瘤周区域富集。低瘤内Treg和高活化CD8+ T细胞数量与患者良好的预后相关。Treg细胞在HCC中介导T细胞功能障碍,其在肿瘤内的存在与较差的预后相关。在HCC中,PD- 1及其配体PD- L /2的表达被广泛研究。在生理条件下,它们的表达是一种防御机制,以防止自反应T细胞的激活和健康细胞的死亡。
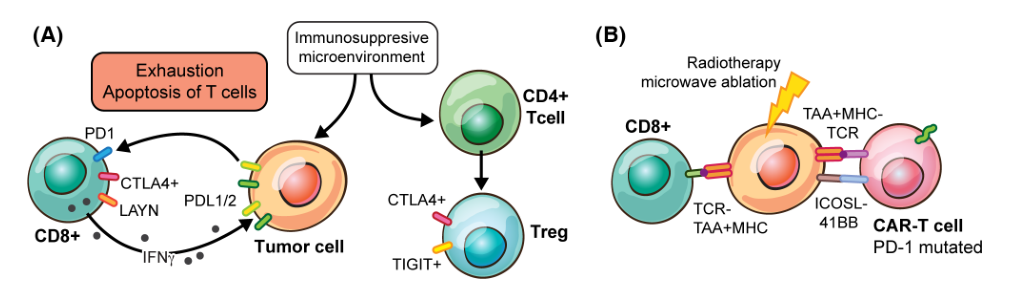
(B)不同代的嵌合抗原受体(CAR)- T细胞被设计成识别肿瘤细胞,杀死它,并保持“非耗尽”(程序性细胞死亡- 1 [PD- 1]缺失)。
- B细胞联合起来抑制或促进癌症
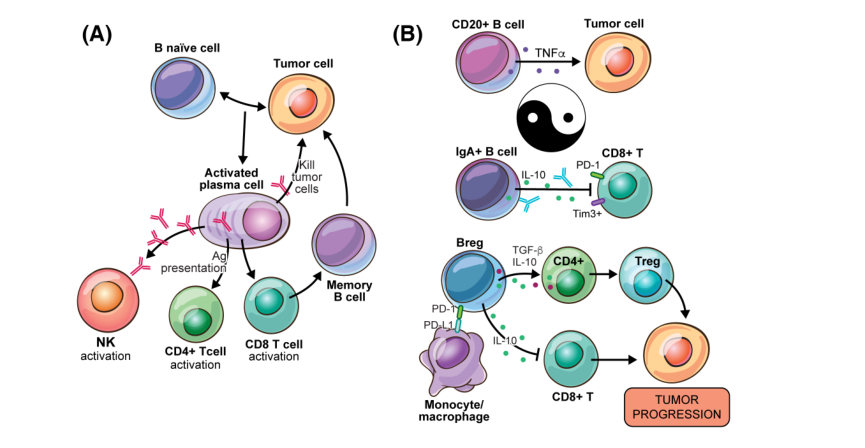
(B) CD20+ B细胞可以通过分泌TNF- α来限制肿瘤的生长。然而,IgA+ B细胞和调节B细胞(Bregs)通过分泌IL- 10和转化生长因子β (TGF- β)抑制T细胞。这种免疫抑制环境也会引发单核细胞和巨噬细胞的极化,从而加强免疫抑制。